Modulators of the Hepcidin Pathway in Polycythemia Vera and Myelofibrosis
Çalışma, polisitemi vera (PV) ve miyelofibroz (MF) hastalarında hepsidin düzeylerini ve bu düzeyleri etkileyen moleküler mekanizmaları analiz ediyor.
1. Amaç
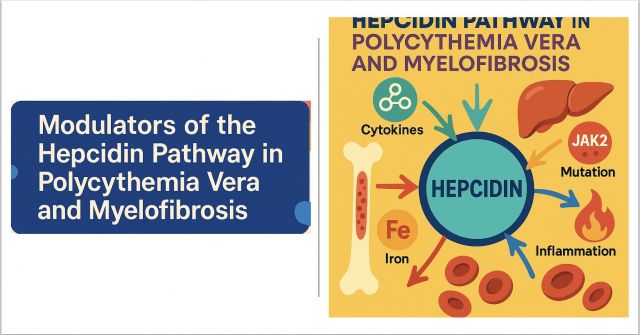
Hepsidin, karaciğerde sentezlenen bir peptid hormondur ve vücuttaki demir dengesinin ana düzenleyicisidir. Ferroportin adlı demir taşıyıcısına bağlanarak demirin dolaşıma geçmesini engeller.
Hepsidin yüksekse → demir emilimi ve salınımı azalır.
Hepsidin düşükse → demir fazlalığı ve eritrositoz ortaya çıkabilir.
Polisitemi vera (PV) ve miyelofibroz (MF), JAK2 mutasyonlarıyla ilişkili miyeloproliferatif neoplazmlar (MPN)grubundadır.
Bu hastalarda eritropoez artışı, sitokin dengesizlikleri, demir yetersizliği ve hepsidin baskılanması sık görülür.
Makalenin amacı, PV ve MF’de hepsidin ekspresyonunu modüle eden yolları (BMP/SMAD, IL-6/STAT3, ERFE vb.)belirlemek ve bunların klinik sonuçlarla ilişkisini açıklamaktır.
2. Yöntem
Hasta grubu: PV, primer MF ve sekonder MF hastaları dahil edilmiştir.
Kontroller: Yaşa ve cinsiyete uygun sağlıklı bireyler.
Analizler:
Serum hepsidin, ferritin, eritroferron (ERFE), IL-6 düzeyleri ölçüldü.
JAK2V617F alel yükü, hepsidin gen ekspresyonu (HAMP) ve BMP/SMAD sinyal proteinlerideğerlendirildi.
Kemik iliği biyopsileri, eritroid aktivite ve fibroz derecesine göre incelendi.
İstatistiksel analizlerde korelasyon katsayıları, regresyon modelleri ve ROC eğrileri kullanıldı.
3. Bulgular
🔹 Hepsidin Düzeyleri
PV ve MF hastalarında hepsidin düzeyleri anlamlı şekilde düşüktü.
PV’de düşüş, artmış eritroferron (ERFE) üretimiyle ilişkiliydi; MF’de ise inflamatuvar sitokinlerin etkisiyle karmaşık bir regülasyon vardı.
Hepsidin/ferritin oranı, eritroid aktiviteyi ve demir tüketimini yansıtan güçlü bir göstergedir.
🔹 Eritroferron (ERFE)
ERFE, eritropoez sırasında hepsidin baskılanmasında anahtar faktördür.
PV hastalarında yüksek hemoglobin ve düşük hepsidin düzeyleriyle güçlü pozitif ilişki gösterdi.
MF hastalarında ERFE artışı daha ılımlı olup, inflamatuvar baskı nedeniyle hepsidin düşüşü sınırlıydı.
🔹 Sitokin Etkisi
IL-6 ve diğer proinflamatuvar mediatörler MF’de hepsidini artırıcı yönde etki etti.
PV’de baskın mekanizma eritroferron kaynaklı baskılama iken, MF’de IL-6 aracılı aktivasyon ve BMP/SMAD sinyal bozulması öne çıktı.
🔹 Moleküler Bulgular
BMP6 ve SMAD4 ekspresyonu MF’de azalmış, PV’de normaldi.
HAMP gen ekspresyonu, serum hepsidin düzeyleriyle koreleydi.
JAK2V617F alel yükü, hepsidin düzeyini dolaylı olarak etkileyerek eritroferron ekspresyonunu artırdı.
4. Klinik İlişkilendirmeler
PV hastaları: Düşük hepsidin → artmış demir mobilizasyonu → yüksek eritrosit üretimi.
MF hastaları: İnflamasyon aracılı hepsidin artışı → fonksiyonel demir eksikliği → anemi.
Bu zıt mekanizmalar, aynı MPN spektrumu içinde farklı demir metabolizması profilleri oluşturur.
Hepsidin düzeyleri ayrıca:
Serum ferritin, hemoglobin ve IL-6 düzeyleriyle istatistiksel olarak anlamlı ilişkili bulundu.
Progresyon riski ve tedavi yanıtı ile de bağlantılı olabileceği öne sürüldü.
5. Tartışma
Çalışma, hepsidin düzenlenmesinde eritropoez sinyalleri (ERFE) ile inflamatuvar sinyaller (IL-6, BMP/SMAD)arasındaki dengeyi vurgulamaktadır:
PV’de eritropoietik baskınlık → düşük hepsidin → demir artışı.
MF’de inflamatuvar baskınlık → yüksek hepsidin → anemi ve demir kapanması.
Bu farklı mekanizmalar, hastalıkların klinik fenotipini (eritrositoz vs. anemi) açıklamaktadır.
Ayrıca, hepsidin/ERFE ekseni, hedeflenebilir bir tedavi noktası olarak öne çıkmaktadır.
6. Sınırlılıklar
Hasta sayısı sınırlıdır (özellikle MF alt tiplerinde).
Serum ölçümleri tek zamanlı olup dinamik değişimleri yansıtmayabilir.
Hepsidin ölçüm yöntemleri arasında (ELISA vs. LC-MS/MS) varyasyon olabilir.
Nedensellik değil, ilişki düzeyinde sonuçlar sunmaktadır.
7. Sonuç
Hepsidin baskılanması PV’nin karakteristik özelliğidir ve artmış eritropoez ile ilişkilidir.
MF’de inflamasyonun baskınlığı, hepsidin düzeylerini yükselterek fonksiyonel demir eksikliğine yol açar.
ERFE, IL-6 ve BMP6/SMAD4 yolları, hepsidin dengesini modüle eden temel faktörlerdir.
Hepsidin/ERFE düzeylerinin birlikte değerlendirilmesi, MPN’lerde tanısal ve prognostik bir biyobelirteç olarak kullanılabilir.
Bu eksen, gelecekte demir metabolizması hedefli tedaviler (ör. hepsidin agonistleri/antagonistleri) için yeni stratejiler geliştirilmesine zemin hazırlamaktadır.
Modulators of the Hepcidin Pathway in Polycythemia Vera and Myelofibrosis
Marina Kremyanskaya, MD PhD*1; Yelena Z. Ginzburg, MD1; and Ronald Hoffman, MD1 1 Tisch Cancer Institute, Icahn School of Medicine at Mount Sinai, New York, NY





